- IMMUNOCHIMIE - Réaction antigène-anticorps
- IMMUNOCHIMIE - Réaction antigène-anticorpsLa réaction Ag-Ac est un processus bi- ou multimoléculaire à modalités variées se traduisant, en fonction des caractéristiques structurales des molécules réagissantes et du milieu réactionnel, par des phénomènes physicochimiques et biologiques macroscopiques d’une grande diversité. La réaction peut être considérée à deux niveaux: élémentaire et global. De ce fait, elle implique la mise en œuvre de techniques d’étude différentes pour son étude analytique. Ces deux niveaux permettent de distinguer respectivement une interaction primaire et des réactions (ou des manifestations) qualifiées de secondaires pour les systèmes in vitro et de tertiaires pour les systèmes in vivo (tabl. 1).La réaction primaire concerne le processus élémentaire (au niveau moléculaire) de la combinaison épitope-site anticorps indépendamment des divers phénomènes physiocochimiques et biologiques qui peuvent en résulter secondairement (précipitation, agglutination, cytolyse, etc.). La réaction primaire se déroule généralement selon une cinétique très rapide. Différentes méthodes décrites plus loin permettent dans certaines conditions la mesure quantitative des paramètres de cette interaction auxquels sont liés les concepts d’affinité et d’avidité des anticorps.Les réactions secondaire ou tertiaire concernent le phénomène réactionnel dans sa globalité c’est-à-dire dans ses manifestations expérimentales et physiopathologiques. À la suite de l’interaction primaire, le processus réactionnel se déroule selon une cinétique relativement plus lente et par des réactions dont l’analyse moléculaire détaillée reste encore difficile et souvent limitée en raison de la complexité des phénomènes qu’elles reflètent, du fait de la structure même des antigènes et des anticorps, de l’hétérogénéité de ces derniers et de la nature du milieu réactionnel (phases homogènes ou hétérogènes). Il convient donc d’analyser d’abord ces différents paramètres.Les manifestations secondaires des interactions primaires sont nombreuses. Les phénomènes d’immunoprécipitation, d’agglutination et les réactions impliquant le complément, pour ne citer que les plus courants, bien que traduisant les réactions élémentaires anticorps-épitopes, ont des caractéristiques propres indépendantes de cette interaction. Ainsi certains anticorps donnent lieu à des précipités mais d’autres ne présentent pas cette propriété. Les réactions d’agglutination sont 50 à 100 fois moins sensibles pour les IgG que pour les IgM. Les IgA et les IgE qui ne fixent pas le composant C1q du système complément n’interviennent pas dans les phénomènes de cytolyse impliquant la participation de ce système. L’utilité des réactions secondaires est toutefois considérable pour l’analyse qualitative et quantitative des antigènes et des anticorps et de la réaction Ag-Ac.1. Paramètres de la réaction épitope (ou haptène)-site anticorpsMultivalence et structure physique et chimique de l’antigèneSauf exception, les antigènes sont multivalents, c’est-à-dire qu’une molécule d’antigène peut fixer plus d’une molécule d’anticorps. Cette multivalence découle de la structure multiépitopique des antigènes [cf. ANTIGÈNES]. Rappelons que les divers épitopes d’une protéine globulaire monomérique sont structuralement différents. En revanche, ils sont répétitifs chez les protéines polymériques, fibrillaires, ou chez celles constituant les capsides virales. Les antigènes homo- et hétéropolyosidiques dont la masse moléculaire est parfois très élevée (face=F0019 礪 106-107 daltons) possèdent des déterminants identiques (uniques ou peu nombreux) répétés un grand nombre de fois sur la molécule: une telle structure multiépitopique répétitive confère dans ce cas une physionomie particulière à la réaction Ag-Ac.La structure physique de l’antigène détermine les caractéristiques de la réaction. Au contact d’un immunsérum ou d’une solution d’anticorps purifiés, l’antigène sous forme de molécules libres en solution, formera des complexes immuns, solubles ou insolubles, de composition Ag-Ac variable déterminée par la multivalence des deux entités réagissantes et par leurs concentrations respectives. In vitro la réaction se manifestera par une précipitation visible à l’œil nu, qui est une des réactions les plus importantes de l’immunochimie. L’antigène peut être sous forme insoluble, soit comme constituant localisé à la surface d’une cellule ou d’un virus, soit comme molécule artificiellement fixée à des cellules (hématies le plus souvent) ou sur des particules inertes (latex, bentonite). Dans une suspension antigénique particulaire se formeront, au contact des anticorps homologues, des agrégats visibles à l’œil nu, avec clarification de la suspension due à la sédimentation des agrégats dans le mélange réactionnel. C’est la réaction d’agglutination , qui prend le nom d’hémagglutination quand les particules sont des hématies (elles perdent souvent leur forme biconcave lorsque les forces de liaison Ag-Ac sont grandes).Une autre réaction dite d’immobilisation s’observe au microscope lorsque les antigènes constitutifs de cils, flagelles ou pili à la surface de nombreux micro-organismes mobiles (p. ex. les paramécies, les tréponèmes, etc.) sont au contact des anticorps homologues. Il en résulte une immobilisation de ces cellules et éventuellement leur rassemblement en amas parfois visibles à l’œil nu. Un tel type de réaction est utilisé dans le diagnostic d’affections microbiennes, notamment les tréponématoses (syphilis).Enfin, l’antigène peut être immobilisé in vitro sur une surface solide inerte ou insolubilisé par polymérisation (au glutaraldéhyde le plus souvent) en vue de son utilisation comme immunosorbant (immunoadsorbant) pour fixer les anticorps homologues. Cette technique permet de purifier ces anticorps à partir d’un immunsérum en dissociant, au moyen de solutions acides (pH 麗 3) ou de solutions salines concentrées à pH neutre, les complexes Ag-Ac.Multiplicité et hétérogénéité structurale et fonctionnelle des anticorpsL’expérience montre que la réponse immunitaire humorale à un antigène donne naissance, sauf rares exceptions, non pas à un type unique d’anticorps spécifiques, mais à une multiplicité d’anticorps différant par de nombreuses caractéristiques. Ce polymorphisme est lié à des variations dans la structure primaire des chaînes polypeptidiques de ces populations d’anticorps spécifiques de l’antigène.Trois niveaux d’hétérogénéité sont à considérer en ce qui concerne la réaction Ag-Ac:– Pour un antigène possédant x épitopes différents (a , b , c ...), l’immunsérum homologue pourra contenir théoriquement autant (disons x populations différentes) de molécules d’anticorps que d’épitopes, chacune étant spécifique d’un épitope et d’un seul (anti-a , anti-b , anti-c ...). Rappelons [cf. ANTIGÈNES] qu’un épitope est défini comme la plus petite entité structurale reconnue par un anticorps.– La population d’anticorps spécifiques d’un épitope donné a est en règle générale hétérogène. Elle est constituée d’un ensemble le plus souvent indéterminé de n espèces d’immunoglobulines distinctes (anti-a 1, ..., anti-a n ) différant par leur affinité intrinsèque (définie plus loin) vis-à-vis de l’épitope (complémentarité plus ou moins étroite).– La population d’anticorps spécifiques des différents épitopes d’un antigènes peut être hétérogène sur le plan de l’isotype. Elle peut appartenir pour une spécificité donnée à plusieurs classes d’immunoglobulines. La valence pourra donc être de deux (nombre de sites anticorps/molécule) pour les IgG, de quatre pour certaines IgA et théoriquement de dix (mais souvent moins en raison d’empêchement stérique) pour les IgM.La multiplicité des anticorps vis-à-vis d’un épitope reflète la stimulation d’autant de clones de lymphocytes B. Pour certains antigènes (polyosides), l’hétérogénéité peut être restreinte; enfin des anticorps strictement homogènes, donc d’origine monoclonale, s’obtiennent expérimentalement par la technique des hybridomes (Milstein et Köhler) ou dans les myélomes spontanés ou induits expérimentalement (Potter). L’intérêt de l’utilisation de tels anticorps monoclonaux pour l’étude fine de la réaction Ag-Ac est évident.Comme pour les antigènes, les anticorps intervenant dans une réaction Ag-Ac peuvent être des molécules libres en solution (liquide biologique ou anticorps purifiés dissous), sous forme insolubilisée chimiquement, fixée à des surfaces inertes (techniques immunoenzymatiques et radioimmunologiques) ou naturellement présents sur des cellules. Dans ce dernier cas, ils peuvent être sur des lymphocytes B ou fixés (anticorps homocytotropes ou cytophiles) par leur fragment Fc sur des récepteurs membranaires à la surface des macrophages, des mastocytes et des polynucléaires basophiles. La combinaison de l’antigène avec les anticorps fixés sur ces deux derniers types de cellules entraîne leur dégranulation avec libération d’histamine. Ce phénomène est à la base de l’hypersensibilité immédiate [cf. ALLERGIE ET HYPERSENSIBILITÉ].État physique macroscopique du système réactionnelLa réaction Ag-Ac peut se dérouler en phase homogène (milieu liquide ou gélifié) ou en phase hétérogène (phase liquide et solide). Si les complexes insolubles se forment en phase homogène, le système deviendra biphasique, du moins à l’interface milieu-complexe, car les réactions se poursuivent entre les molécules solubles de la phase homogène et celles du précipité. Les réactions Ag-Ac en phase hétérogène sont nombreuses et présentent des aspects multiples. La phase solide peut être une surface inerte, des cellules, l’antigène ou l’anticorps insolubilisé ou précipité. De nombreux paramètres physiques sont critiques: température, pH, environnement ionique, etc.2. Forces moléculaires de liaison impliquées dans la réaction antigène-anticorpsLes mesures thermodynamiques montrent que la combinaison site antigénique (ou haptène)-site anticorps est réversible et implique une énergie de liaison d’environ 34 à 65 kilojoules/mole. Ces données éliminent d’emblée des liaisons covalentes (mise en commun d’électrons périphériques entre atomes) dont l’énergie varie entre 210 et 500 kJ . mol-1. Dans la réaction Ag-Ac, les forces de liaison sont uniquement des interactions «faibles» non covalentes dont quatre types différents contribuent à des degrés divers (variables selon les systèmes et assez mal définis) à l’union Ag-Ac. Ces forces sont les suivantes: interactions ioniques, interactions de Van der Waals, liaisons hydrogènes et interactions hydrophobes.Ces forces sont les mêmes que celles qui assurent la stabilisation des configurations tridimensionnelles et quaternaires des protéines et autres macromolécules biologiques, ainsi que l’association stéréospécifique de ligands avec ces macromolécules (couples substrat-enzyme, oses-lectines, et plus généralement effecteur-récepteur...).Contrairement aux liaisons covalentes, les liaisons non covalentes dont l’énergie moyenne varie selon les types mentionnés d’environ 4,2 à 30 kJ . mol-1 se forment et se rompent en permanence aux températures intéressant le biologiste (290-310 K). Ces énergies sont en effet de peu supérieures à l’énergie cinétique moyenne (face=F0019 黎 2,5 à 3,3 kJ . mol-1) à ces températures (agitation thermique), et cette caractéristique rend compte de la réversibilité de la réaction Ag-Ac (ligand-récepteur plus généralement), c’est-à-dire de l’équilibre entre le complexe Ag-Ac et les formes libres. Il s’ensuit que la spécificité de la réaction, c’est-à-dire la stabilité du complexe, ne sera possible que par la mise en jeu simultanée d’un nombre suffisant d’interactions élémentaires. L’affinité du site anticorps reflétera donc ce nombre et leur répartition spatiale la plus appropriée pour assurer la meilleure complémentarité possible dont la réalité physique («emboîtement» des entités réagissantes) a été démontrée par l’étude par diffraction aux rayons X.Caractéristique fondamentale, toutes les forces non covalentes agissent à des distances interatomiques très faibles. Elles sont d’autant plus fortes (attraction) que la distance entre les groupes réagissants est plus courte (donc complémentarité plus étroite) jusqu’à la limite où des forces de répulsion entrent en jeu à l’approche du rayon de Van der Waals en raison de l’interpénétration des couches électroniques externes des atomes en contact.Les interactions hydrophobes appelées également apolaires sont particulièrement importantes dans la réaction Ag-Ac et fourniraient jusqu’à environ 50 p. 100 de la force totale de liaison. Elles concernent l’attraction entre groupements non polaires hydrophobes (cas des chaînes latérales de certains acides aminés aliphatiques ou aromatiques). Ceux-ci ont spontanément tendance, en milieu aqueux, à adopter une disposition qui leur permet de se soustraire à cet environnement en s’associant en une structure excluant les molécules d’eau. Le processus endothermique ( G 麗 0) se traduit par une réduction de l’énergie interne du système avec augmentation concomitante de l’entropie et, de ce fait, création d’une force attractive. À l’inverse de ce qu’on observe pour la formation d’une liaison hydrogène, le terme enthalpique est plutôt positif: alors qu’une élévation de température tend à rompre les liaisons hydrogènes, elle stabilise au contraire les interactions hydrophobes. La contribution de ces interactions, calculée d’après l’augmentation de l’entropie qui accompagne l’expulsion de molécules d’eau des structures quasi cristallines (dites «icebergs de Franck-Evans») autour des groupements apolaires, est de l’ordre de 5,8 kJ . mol-1.3. Affinité des anticorpsL’affinité des anticorps se conçoit comme la résultante des forces attractives et répulsives établies entre les anticorps et les épitopes homologues de l’antigène correspondant ou avec des haptènes (Steward). La nature même de la réaction Ag-Ac amène à distinguer, d’une part, au niveau élémentaire l’affinité intrinsèque d’un anticorps individuel pour la structure homologue qu’il reconnaît (interaction primaire) et, d’autre part, l’affinité fonctionnelle (terme proposé par Karush de préférence à «avidité des anticorps» antérieurement utilisé) qui concerne l’interaction globale de l’ensemble bi- ou multivalent et hétérogène de la population d’anticorps (cf. infra , Affinité fonctionnelle ), avec les différents épitopes de l’antigène. L’affinité fonctionnelle est toujours supérieure à la somme des affinités intrinsèques du système. Ce phénomène d’amplification parfois considérable (facteur 100 ou 1 000) analysé plus loin résulte de la multivalence des molécules réagissantes.Affinité intrinsèqueConsidérons l’interaction individuelle entre un haptène monovalent libre ou un épitope naturel ou hapténique d’un antigène, que nous désignerons indistinctement par le terme de ligand L, et un site anticorps d’une molécule d’immunoglobuline donnée, ou son fragment monovalent Fab, que nous appellerons indistinctement P. La réaction entre les deux entités L et P est réversible et peut se représenter par l’équation:
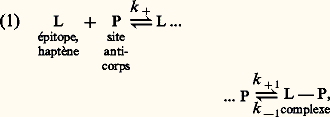 où k + et k - sont respectivement les constantes de diffusion de l’interaction de positionnement approprié de P et L et de leur retour de l’état initial, k +1 (également symbolisé k a ) est la constante de vitesse de la réaction d’association (réaction directe) et k -1 est la constante de vitesse de la réaction de dissociation (réaction inverse) après positionnement ferme de P et L. La réaction est bimoléculaire (d’ordre 2) dans le sens de l’association et monomoléculaire (d’ordre 1) dans le sens de la dissociation. La vitesse de la formation du complexe L 漣 P est:
où k + et k - sont respectivement les constantes de diffusion de l’interaction de positionnement approprié de P et L et de leur retour de l’état initial, k +1 (également symbolisé k a ) est la constante de vitesse de la réaction d’association (réaction directe) et k -1 est la constante de vitesse de la réaction de dissociation (réaction inverse) après positionnement ferme de P et L. La réaction est bimoléculaire (d’ordre 2) dans le sens de l’association et monomoléculaire (d’ordre 1) dans le sens de la dissociation. La vitesse de la formation du complexe L 漣 P est: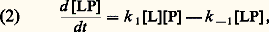 où [L], [P] et [LP] sont respectivement les concentrations de ligand libre, de site anticorps libre et du complexe au temps t .Lorsque l’équilibre est atteint, la vitesse est nulle, il se forme autant de molécules de complexes qu’il s’en dissocie (l’équation 2 = 0) d’où la relation (loi d’action de masse):
où [L], [P] et [LP] sont respectivement les concentrations de ligand libre, de site anticorps libre et du complexe au temps t .Lorsque l’équilibre est atteint, la vitesse est nulle, il se forme autant de molécules de complexes qu’il s’en dissocie (l’équation 2 = 0) d’où la relation (loi d’action de masse):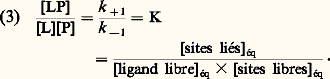 La constante d’équilibre K, appelée aussi constante d’association intrinsèque, est, par définition, l’affinité intrinsèque de l’anticorps. Celle-ci a donc une définition thermodynamique quantitative précise. K, dénoté parfois Ka , a les dimensions d’un inverse de concentration, et s’exprime donc en litre/mole (L mol-1 ou M-1). Notons que l’équation (3) indique que deux réactions réversibles peuvent avoir une constante K identique mais des constantes de vitesse différentes. Certains auteurs expriment l’équilibre de la réaction (1) par le rapport:
La constante d’équilibre K, appelée aussi constante d’association intrinsèque, est, par définition, l’affinité intrinsèque de l’anticorps. Celle-ci a donc une définition thermodynamique quantitative précise. K, dénoté parfois Ka , a les dimensions d’un inverse de concentration, et s’exprime donc en litre/mole (L mol-1 ou M-1). Notons que l’équation (3) indique que deux réactions réversibles peuvent avoir une constante K identique mais des constantes de vitesse différentes. Certains auteurs expriment l’équilibre de la réaction (1) par le rapport: Plus K sera élevé, meilleure sera l’affinité de l’anticorps et donc la stabilité du complexe LP. Les valeurs de K varient entre 105 (faible affinité) à 109 (forte affinité) et même 1012 L mol-1. Il est important de souligner qu’à part les anticorps monoclonaux dont l’affinité est homogène (valeur unique) la plupart des anticorps spécifiques d’un ligand, fût-il un haptène très simple, forment une population hétérogène (entre autres types d’hétérogénéité) ayant un spectre variable d’affinité. L’affinité mesurée selon l’équation (3) sera une affinité intrinsèque moyenne, K0, qui est la moyenne des constantes d’association intrinsèque de chacun des anticorps formant cette population de molécules.On peut observer d’après l’équation (3) que, si à une quantité fixe d’anticorps on ajoute des quantités croissantes de ligand, on obtiendra, pour une certaine quantité de ligand, un mélange en équilibre dans lequel la moitié des sites anticorps sont occupés par le ligand. Dans ce cas [LP] = [P] et K ou Ka = 1 [L]. En d’autres termes, l’affinité est égale à l’inverse de la concentration en ligand libre quand la moitié des sites anticorps est occupée. Les techniques expérimentales de mesure de l’affinité intrinsèque figurent au tableau 2 et seront décrites plus loin dans le cadre des réactions primaires Ag-Ac.Aspects thermodynamiques de la réaction ligand-site anticorpsLa formation du complexe L 漣 P de la réaction (1) entraîne une variation de l’énergie libre standard G0 du système (cf. THER- MODYNAMIQUE - Thermodynamique chimique) reliée à la constante d’équilibre K par l’équation:
Plus K sera élevé, meilleure sera l’affinité de l’anticorps et donc la stabilité du complexe LP. Les valeurs de K varient entre 105 (faible affinité) à 109 (forte affinité) et même 1012 L mol-1. Il est important de souligner qu’à part les anticorps monoclonaux dont l’affinité est homogène (valeur unique) la plupart des anticorps spécifiques d’un ligand, fût-il un haptène très simple, forment une population hétérogène (entre autres types d’hétérogénéité) ayant un spectre variable d’affinité. L’affinité mesurée selon l’équation (3) sera une affinité intrinsèque moyenne, K0, qui est la moyenne des constantes d’association intrinsèque de chacun des anticorps formant cette population de molécules.On peut observer d’après l’équation (3) que, si à une quantité fixe d’anticorps on ajoute des quantités croissantes de ligand, on obtiendra, pour une certaine quantité de ligand, un mélange en équilibre dans lequel la moitié des sites anticorps sont occupés par le ligand. Dans ce cas [LP] = [P] et K ou Ka = 1 [L]. En d’autres termes, l’affinité est égale à l’inverse de la concentration en ligand libre quand la moitié des sites anticorps est occupée. Les techniques expérimentales de mesure de l’affinité intrinsèque figurent au tableau 2 et seront décrites plus loin dans le cadre des réactions primaires Ag-Ac.Aspects thermodynamiques de la réaction ligand-site anticorpsLa formation du complexe L 漣 P de la réaction (1) entraîne une variation de l’énergie libre standard G0 du système (cf. THER- MODYNAMIQUE - Thermodynamique chimique) reliée à la constante d’équilibre K par l’équation: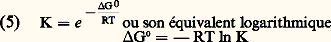 où T est la température absolue exprimée en kelvins (face=F0019 漣 273 0C = 0 K), R la constante des gaz parfaits (8,314 J . K-1 . mol-1. G0 constitue donc une autre définition de l’affinité intrinsèque. Sa valeur varie environ entre 24 et 46 kJ . mol-1 pour K variant entre 105 et 109 L mol-1. La valeur de G0 étant calculable à partir de celle de K, on peut également calculer la variation d’enthalpie H0 et d’entropie S0 d’après la relation de Gibbs:
où T est la température absolue exprimée en kelvins (face=F0019 漣 273 0C = 0 K), R la constante des gaz parfaits (8,314 J . K-1 . mol-1. G0 constitue donc une autre définition de l’affinité intrinsèque. Sa valeur varie environ entre 24 et 46 kJ . mol-1 pour K variant entre 105 et 109 L mol-1. La valeur de G0 étant calculable à partir de celle de K, on peut également calculer la variation d’enthalpie H0 et d’entropie S0 d’après la relation de Gibbs: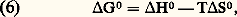 et de Van’t Hoff:
et de Van’t Hoff: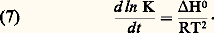 En déterminant K à deux températures différentes 1 et 2, on peut calculer H comme suit:
En déterminant K à deux températures différentes 1 et 2, on peut calculer H comme suit: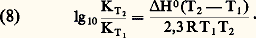 La variation d’entropie (J . K-1 . mol-1) se calcule par la relation:
La variation d’entropie (J . K-1 . mol-1) se calcule par la relation: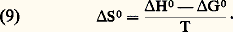 L’équation (6) montre que la variation d’énergie libre G0 résulte de la contribution des paramètres enthalpique et entropique. Selon les systèmes Ag-Ac, l’un ou l’autre de ces paramètres prédomine.Lorsque la variation d’enthalpie est nulle, le terme entropique est dominant, ce qui suggère que les liaisons impliquées sont essentiellement des liaisons hydrophobes (réarrangement de molécules d’eau autour du complexe LH). Lorsque la variation d’enthalpie est prépondérante, les liaisons sont d’un tout autre type. Il s’agira principalement de liaisons hydrogène et ioniques.Techniques de mesure des interactions primaires antigène-anticorps ou haptène-anticorpsDe nombreuses techniques physiques (tabl. 2) permettent la mesure de l’affinité intrinsèque et donc l’interaction primaire. Elles sont pour la plupart basées sur la séparation des molécules de ligand libre et de ligand lié aux anticorps sans toutefois perturber l’équilibre représenté par l’équation (3). Le système expérimental consiste à incuber à une température donnée une quantité fixe d’anticorps et des concentrations croissantes de ligand. On attend l’établissement de l’équilibre et on détermine par un dosage approprié soit la concentration du ligand libre [L] et lié [LP] (ce qui est le plus facile dans la plupart des systèmes et des techniques), soit la concentration des anticorps libres [P] et liés [PL].Le calcul de K (d’après la loi d’action de masse, équation 3) utilise les données suivantes:M = concentration en anticorps (moles/litre);– c = concentration de ligand libre à l’équilibre (moles/litre);– n = nombre total de sites par molécule d’anticorps (valence de l’anticorps);– r = nombre moyen de sites ayant fixé le ligand dans des conditions d’équilibre: nombre de molécules du ligand lié par molécule d’anticorps.Dans l’hypothèse où les sites de la molécule d’anticorps sont équivalents (même valeur de K) et indépendants, c’est-à-dire que la fixation d’un ligand sur un site ne modifie pas l’affinité des autres sites (absence d’effet coopératif positif ou négatif) et pour une population d’anticorps d’affinité unique (monoclonaux), l’équation (3) pourra s’écrire:
L’équation (6) montre que la variation d’énergie libre G0 résulte de la contribution des paramètres enthalpique et entropique. Selon les systèmes Ag-Ac, l’un ou l’autre de ces paramètres prédomine.Lorsque la variation d’enthalpie est nulle, le terme entropique est dominant, ce qui suggère que les liaisons impliquées sont essentiellement des liaisons hydrophobes (réarrangement de molécules d’eau autour du complexe LH). Lorsque la variation d’enthalpie est prépondérante, les liaisons sont d’un tout autre type. Il s’agira principalement de liaisons hydrogène et ioniques.Techniques de mesure des interactions primaires antigène-anticorps ou haptène-anticorpsDe nombreuses techniques physiques (tabl. 2) permettent la mesure de l’affinité intrinsèque et donc l’interaction primaire. Elles sont pour la plupart basées sur la séparation des molécules de ligand libre et de ligand lié aux anticorps sans toutefois perturber l’équilibre représenté par l’équation (3). Le système expérimental consiste à incuber à une température donnée une quantité fixe d’anticorps et des concentrations croissantes de ligand. On attend l’établissement de l’équilibre et on détermine par un dosage approprié soit la concentration du ligand libre [L] et lié [LP] (ce qui est le plus facile dans la plupart des systèmes et des techniques), soit la concentration des anticorps libres [P] et liés [PL].Le calcul de K (d’après la loi d’action de masse, équation 3) utilise les données suivantes:M = concentration en anticorps (moles/litre);– c = concentration de ligand libre à l’équilibre (moles/litre);– n = nombre total de sites par molécule d’anticorps (valence de l’anticorps);– r = nombre moyen de sites ayant fixé le ligand dans des conditions d’équilibre: nombre de molécules du ligand lié par molécule d’anticorps.Dans l’hypothèse où les sites de la molécule d’anticorps sont équivalents (même valeur de K) et indépendants, c’est-à-dire que la fixation d’un ligand sur un site ne modifie pas l’affinité des autres sites (absence d’effet coopératif positif ou négatif) et pour une population d’anticorps d’affinité unique (monoclonaux), l’équation (3) pourra s’écrire: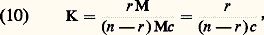 ou sous la forme équivalente (formellement identique à un isotherme d’adsorption de type Langmuir):
ou sous la forme équivalente (formellement identique à un isotherme d’adsorption de type Langmuir): À partir des valeurs expérimentales de r et c , on peut calculer K et n en utilisant un graphe approprié de ces équations mises sous forme d’une relation du premier degré. Une des représentations les plus utilisées est celle de Scatchard (fig. 1) qui exprime r /c en fonction de r :
À partir des valeurs expérimentales de r et c , on peut calculer K et n en utilisant un graphe approprié de ces équations mises sous forme d’une relation du premier degré. Une des représentations les plus utilisées est celle de Scatchard (fig. 1) qui exprime r /c en fonction de r :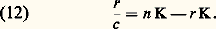 La droite représentative de cette équation a pour pente 漣 K. Son intersection avec l’axe des abscisses permet de calculer la valence n de l’anticorps (r /c = 0 pour r = n correspondant à une concentration en ligand秊).La linéarité de cette fonction (12) n’est observée expérimentalement que dans le cas idéal des anticorps monoclonaux, car leur affinité est homogène. Dans les autres cas, on observe une allure non linéaire des courbes expérimentales, due à l’hétérogénéité du point de vue affinité de la population d’anticorps qui se lie au ligand. Cette déviation sera d’autant plus importante que le spectre des affinités sera plus large. On pourra seulement alors estimer, à partir des données, une valeur K0 moyenne, qui se calcule d’après les graphes pour la concentration en ligand où la moitié des sites anticorps sont liés (r = r d’où K0 = 1/c c’est-à-dire l’inverse de cette concentration).Les mesures les plus aisées et les plus précises pour le calcul de K ou de K0 ont été obtenues avec des haptènes, en raison de la faible taille de ces ligands (monovalents le plus souvent) et du fait qu’ils peuvent être aisément dosés sous leur forme libre ou liée, par radioactivité ou par spectrophotométrie. Parmi les techniques physiques citées dans le tableau 3, la dialyse à l’équilibre et le blocage de la fluorescence sont les plus usuelles.La dialyse s’effectue dans une cellule de dialyse comprenant deux compartiments séparés par une membrane semi-perméable. Les anticorps ne sont ajoutés que dans l’un des deux compartiments. Les haptènes se répartissent entre les deux compartiments et atteignent une distribution d’équilibre caractéristique entre ces deux compartiments. La concentration d’haptènes libres est la même des deux côtés de la membrane mais, du côté où se trouvent les anticorps, il y a, en plus, les haptènes liés aux anticorps. On détermine les valeurs de r pour différentes valeurs de c , à une ou plusieurs températures. Le temps nécessaire pour atteindre l’équilibre est assez long (de 1 à 2 jours), mais cela est dû uniquement à la lenteur de l’équilibration à travers la membrane, car la combinaison avec l’anticorps est pratiquement instantanée (fraction de seconde).Le blocage de la fluorescence se base sur la mesure de la baisse de fluorescence des résidus tryptophanyl des anticorps dans les complexes formés avec le ligand (à condition que la bande d’absorption de celui-ci chevauche avec la bande d’émission de tryptophane, environ 350 nm).Pour les ligands macromoléculaires, on a recours aux techniques de précipitation au sulfate d’ammonium (méthode de Farr), ou au moyen d’autres agents précipitants (tabl. 2), dans des conditions où l’antigène libre (souvent marqué par une radio-isotope, notamment l’iode 125) reste en solution alors que les complexes Ag-Ac et les anticorps libres sont précipités.Affinité fonctionnelleLes interactions définies dans les paragraphes précédents ne concernaient que la liaison d’un ligand et d’un site anticorps, qui a permis une définition précise de l’affinité à ce niveau élémentaire d’interaction. Cependant, sauf exception, la réaction Ag-Ac est un processus impliquant simultanément l’interaction de molécules d’anticorps bivalentes (IgG, IgE) ou multivalentes (IgA, IgM) avec des antigènes multiépitopiques donc multivalentes. Cette réaction peut s’écrire symboliquement:
La droite représentative de cette équation a pour pente 漣 K. Son intersection avec l’axe des abscisses permet de calculer la valence n de l’anticorps (r /c = 0 pour r = n correspondant à une concentration en ligand秊).La linéarité de cette fonction (12) n’est observée expérimentalement que dans le cas idéal des anticorps monoclonaux, car leur affinité est homogène. Dans les autres cas, on observe une allure non linéaire des courbes expérimentales, due à l’hétérogénéité du point de vue affinité de la population d’anticorps qui se lie au ligand. Cette déviation sera d’autant plus importante que le spectre des affinités sera plus large. On pourra seulement alors estimer, à partir des données, une valeur K0 moyenne, qui se calcule d’après les graphes pour la concentration en ligand où la moitié des sites anticorps sont liés (r = r d’où K0 = 1/c c’est-à-dire l’inverse de cette concentration).Les mesures les plus aisées et les plus précises pour le calcul de K ou de K0 ont été obtenues avec des haptènes, en raison de la faible taille de ces ligands (monovalents le plus souvent) et du fait qu’ils peuvent être aisément dosés sous leur forme libre ou liée, par radioactivité ou par spectrophotométrie. Parmi les techniques physiques citées dans le tableau 3, la dialyse à l’équilibre et le blocage de la fluorescence sont les plus usuelles.La dialyse s’effectue dans une cellule de dialyse comprenant deux compartiments séparés par une membrane semi-perméable. Les anticorps ne sont ajoutés que dans l’un des deux compartiments. Les haptènes se répartissent entre les deux compartiments et atteignent une distribution d’équilibre caractéristique entre ces deux compartiments. La concentration d’haptènes libres est la même des deux côtés de la membrane mais, du côté où se trouvent les anticorps, il y a, en plus, les haptènes liés aux anticorps. On détermine les valeurs de r pour différentes valeurs de c , à une ou plusieurs températures. Le temps nécessaire pour atteindre l’équilibre est assez long (de 1 à 2 jours), mais cela est dû uniquement à la lenteur de l’équilibration à travers la membrane, car la combinaison avec l’anticorps est pratiquement instantanée (fraction de seconde).Le blocage de la fluorescence se base sur la mesure de la baisse de fluorescence des résidus tryptophanyl des anticorps dans les complexes formés avec le ligand (à condition que la bande d’absorption de celui-ci chevauche avec la bande d’émission de tryptophane, environ 350 nm).Pour les ligands macromoléculaires, on a recours aux techniques de précipitation au sulfate d’ammonium (méthode de Farr), ou au moyen d’autres agents précipitants (tabl. 2), dans des conditions où l’antigène libre (souvent marqué par une radio-isotope, notamment l’iode 125) reste en solution alors que les complexes Ag-Ac et les anticorps libres sont précipités.Affinité fonctionnelleLes interactions définies dans les paragraphes précédents ne concernaient que la liaison d’un ligand et d’un site anticorps, qui a permis une définition précise de l’affinité à ce niveau élémentaire d’interaction. Cependant, sauf exception, la réaction Ag-Ac est un processus impliquant simultanément l’interaction de molécules d’anticorps bivalentes (IgG, IgE) ou multivalentes (IgA, IgM) avec des antigènes multiépitopiques donc multivalentes. Cette réaction peut s’écrire symboliquement: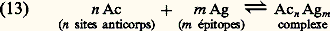 En raison de cette double multivalence, il est impossible de définir une constante d’association globale des anticorps permettant d’évaluer quantitativement l’ensemble des forces mises en jeu pour former le complexe. Pendant longtemps le concept d’avidité avait prévalu comme reflet de cette affinité globale. On pouvait évaluer grossièrement l’avidité d’un immunsérum en étudiant l’effet de la dilution sur un mélange d’antigène et d’immunsérum, ce qui a pour effet de réduire la concentration d’antigène et d’anticorps libre et donc de dissocier le complexe.Une série d’observations expérimentales étayées par diverses approches théoriques a permis d’aboutir au concept d’affinité fonctionnelle, qui traduit le fait que l’affinité d’une molécule d’anticorps bivalente (IgG, IgE) ou multivalente (IgA, IgM) n’était pas égale à la somme arithmétique de l’affinité de chaque site considéré séparément, mais beaucoup plus élevée, souvent par plusieurs ordres de grandeur (102 à 106). En d’autres termes, une stabilité supplémentaire est conférée à un complexe Ag-Ac lorsque la molécule d’anticorps réagit avec plus d’un déterminant. Ce renforcement a été observé aussi bien pour une molécule d’anticorps reliant deux épitopes sur deux molécules d’antigène ou des épitopes répétitifs (liaison monogame) présents sur une même molécule (antigènes polyosidiques) ou sur une même structure (motifs hapténiques répétitifs, épitopes à la surface de cellules ou de capsides virales). L’affinité fonctionnelle, terme qui doit être utilisé de préférence à celui d’avidité, dépend évidemment de l’affinité intrinsèque des sites anticorps, mais implique aussi la contribution d’autres facteurs, tels les valences de l’antigène et de l’anticorps. Différents autres paramètres, non liés directement à l’interaction primaire entre sites, anticorps et épitopes, sont également impliqués dans ce phénomène d’amplification, tels l’amplitude de l’écartement de la région charnière des molécules d’immunoglobulines et, vraisemblablement, différentes conformations topologiques. La réalité de cette amplification de l’affinité a pu être apportée par la mesure comparée de l’affinité de fragments monovalents (Fab) d’IgG ou d’IgM par rapport à celle des molécules intactes.Les implications biologiques de l’affinité fonctionnelle sont très importantes sur le plan de l’immunité anti-bactérienne ou anti-virale et pour les réactions de stimulation à point de départ membranaire (cellules lymphoïdes, cellules tumorales...). Elle peut expliquer la remarquable activité biologique in vivo à très faible concentration des anticorps dirigés contre les micro-organismes, souvent porteurs de motifs répétitifs.Les interactions primaires (étudiées ci-dessus) ne prennent en compte que les réactions entre les molécules d’antigènes et les anticorps homologues indépendamment des effets physicochimiques et biologiques (y compris leurs manifestations macroscopiques) qui en découlent. Ces réactions dépendent uniquement de la quantité et de l’affinité des anticorps.Les manifestations secondaires des interactions primaires sont nombreuses (tabl. 1). Les phénomènes d’immunoprécipitation, d’agglutination et les réactions impliquant le complément, pour ne citer que les plus courants bien que traduisant les réactions élémentaires sites anticorps-épitopes, ont des caractéristiques propres indépendantes de cette interaction. Ainsi, certains anticorps donnent bien lieu à des précipités; mais d’autres ne présentent pas cette propriété. Les réactions d’agglutination sont 50 à 100 fois moins sensibles pour les IgG que pour les IgM. Les IgA et les IgE qui ne fixent pas le composant C1q du système complément n’interviennent pas dans les phénomènes de cytolyse impliquant la participation de ce système. L’utilité des réactions secondaires est toutefois considérable pour l’analyse qualitative et quantitative des antigènes et des anticorps et de la réaction Ag-Ac, notamment pour ce qui est des réactions de précipitation, des réactions immunoenzymatiques et des réactions d’agglutination.4. Réactions de précipitation (immunoprécipitation)Véritable modèle du genre par sa simplicité et son immense champ d’application, la précipitation spécifique entre un antigène et les anticorps homologues est indiscutablement la plus importante réaction Ag-Ac in vitro . Cette réaction, dans ses deux aspects qualitatif et quantitatif, aussi bien en milieu liquide qu’en milieu gélifié, a eu une importance historique considérable par les progrès théoriques et pratiques qu’elle a permis de réaliser en immunologie, non seulement sur le plan analytique, mais aussi pour le développement de nombreux concepts fondamentaux de cette discipline.Découverte en 1897 par Kraus, cette réaction se traduit par la formation plus ou moins rapide (quelques minutes à plusieurs heures) d’un agrégat (appelé parfois floculat) visible à l’œil nu lorsqu’on mélange, dans des proportions appropriées et à des concentrations suffisantes, un immunsérum ou une solution d’anticorps avec une solution de l’antigène homologue. L’agrégat, d’abord dispersé dans l’ensemble de la phase liquide, se dépose progressivement sous la forme d’un précipité dans le mélange réactionnel dont il peut être séparé par centrifugation.Si, au lieu de mélanger la solution d’antigène et l’immunsérum, on les superpose (sans mélange) dans un tube fin, l’immunsérum plus dense étant au fond, le précipité formé se présente sous la forme d’un disque fin visible qui apparaît en quelques minutes (pour un sérum de bonne affinité) à l’interface des deux liquides. Cette épreuve qualitative de précipitation interfaciale, ou «ring-test», est couramment utilisée comme méthode exploratoire rapide et fiable pour la détection des anticorps précipitants dans un immunsérum. Mais c’est surtout après l’établissement des méthodes quantitatives d’étude de la réaction de précipitation Ag-Ac par M. Heidelberger et son école (Wu, Randall), à partir de 1928, puis par E. Kabat, que cette réaction connut son véritable essor comme fondement de l’immunochimie quantitative .L’importance de cette méthodologie a été capitale à plusieurs égards:– elle a permis de démontrer de manière définitive que les anticorps étaient des protéines;– elle a introduit une dimension quantitative en immunologie (dosage des antigènes et des anticorps) qui, jusqu’alors, était restée essentiellement descriptive;– elle a conduit à proposer puis à démontrer la multivalence des antigènes, la divalence ou la multivalence des anticorps et de ce fait, à permis à Marrack dès 1933 de proposer la théorie du réseau décrit plus loin;– elle a permis de démontrer l’immunogénicité de macromolécules autres que les protéines, notamment les polyosides dont la structure répétitive a permis d’en utiliser des fragments comme haptènes pour déterminer la taille des épitopes et du site anticorps.En 1946, à l’Institut Pasteur de Paris, Jacques Oudin eut l’idée de remplacer le milieu liquide, dans lequel la réaction de précipitation était jusque-là effectuée, par un milieu gélifié qui freinerait la sédimentation. Ce type d’analyse, complété à partir de 1953 par l’introduction d’un champ électrique, proposé par P. Grabar et C. Williams, devait s’avérer l’outil le plus puissant pour l’analyse de mélanges même très complexes d’antigènes ou d’anticorps (ce qui ne peut être réalisé par la précipitation en milieu liquide). Il devait être également à la base de la découverte par J. Oudin des phénomènes fondamentaux que sont l’allotypie et l’idiotypie.Précipitation quantitative en milieu liquideLa réaction de précipitation Ag-Ac est un processus complexe qui peut se décomposer en deux stades: d’abord combinaison des divers épitopes et des sites anticorps homologues (interaction primaire) de cinétique rapide de l’ordre de la fraction de seconde; ensuite, réactions secondaires en chaînes, variables selon les proportions d’antigènes et d’anticorps qui aboutissent à la formation des agrégats et à leur insolubilisation éventuelle. Ce deuxième stade se déroule beaucoup plus lentement que le premier et sa vitesse dépend des rapports de concentration des espèces moléculaires présentes et de caractéristiques propres à chaque système.Ces données permettent d’envisager l’évaluation quantitative de deux types de paramètres: le temps d’apparition des précipités et la quantité d’anticorps précipité. Selon le paramètre choisi, deux méthodologies différentes s’appliquent. Celle basée sur le temps de précipitation (techniques dites de floculation de Ramon et de Dean et Webb) n’est utilisée que de manière limitée et s’applique au dosage des toxines bactériennes ou de venins et de leurs anticorps. En revanche, la mesure de la quantité d’anticorps précipité, c’est-à-dire l’établissement de la courbe de précipitation quantitative antigène – anticorps, est de portée beaucoup plus générale et très largement utilisée. Outre son intérêt théorique mentionné plus haut, elle permet le dosage précis des antigènes et de leurs anticorps précipitants. Elle sert aussi de base pour les autres techniques de mesure de la réaction Ag-Ac pour estimer les rapports éventuels entre les titres en anticorps trouvés par ces techniques et la teneur en anticorps précipitants.La figure 2 rassemble l’ensemble des résultats expérimentaux et leur interprétation. Pour la plupart des immunsérums humains ou de différentes espèces animales (sauf pour certains sérums équins), le graphe qui représente la quantité de complexe Ag-Ac précipité en fonction de la quantité d’antigène possède une allure parabolique (courbe 1). La quantité de complexe augmente pour atteindre un point maximum puis diminue. L’analyse des surnageants et des précipités montre que l’on peut distinguer trois zones: une zone centrale II, dite zone d’équivalence pour laquelle l’antigène et l’anticorps introduits sont totalement dans le précipité, entourée à gauche par une zone d’excès d’anticorps (I) mais où tout l’antigène est (en principe) dans le précipité et, à droite, par une zone d’excès d’antigène (III), où une partie de celui-ci est sous forme de complexe soluble et l’autre partie est dans le précipité. Plus la quantité d’antigène sera élevée plus la fraction de complexe soluble sera importante.Une fois connus les poids des complexes immuns précipités, on peut évaluer la quantité d’anticorps précipité. Si l’antigène n’est pas protéique, la totalité des protéines du précipité représentera l’anticorps. La situation est plus complexe lorsque l’antigène est protéique car il faudra déduire de la quantité totale d’azote ou de protéine du précipité, celle correspondant à l’antigène (courbe 2). Cette opération n’a de sens que dans la zone d’excès d’anticorps et d’équivalence où, a priori, tout l’antigène introduit est dans le précipité. Si l’on désire connaître la quantité d’anticorps précipité en zone d’excès d’antigène (courbe 2 en pointillé), celui-ci devrait pouvoir être repérable par marquage avec un radio-isotope ou par une fluorochrome. Connaissant la quantité d’anticorps dans les précipités, il est alors possible de calculer, pour chaque mélange Ag-Ac étudié, le rapport de molécules d’Ac et d’Ag dans les complexes insolubles. Ce rapport décroît pour beaucoup de systèmes linérairement avec la quantité x d’antigène introduit (courbe 3).La stoechiométrie complexe de la réaction de précipitation s’explique par l’implication simultanée de trois facteurs: divalence ou multivalence des anticorps; multivalence (structure multiépitopique) des antigènes; réversibilité partielle (lente mais réelle) des complexes.Ces caractéristiques rendent compte de la variabilité de la composition relative en antigène et en anticorps des précipités et des complexes solubles en zone d’excès d’antigène tout le long de la courbe. En excès d’anticorps, chaque molécule multiépitopique d’antigène s’unira avec beaucoup plus de molécules d’anticorps que dans les zones d’équivalence ou d’excès d’antigène. Inversement, en excès d’antigène, le précipité sera plus riche en molécules d’antigène que d’anticorps. On remarquera (fig. 2) que l’extrême limite atteinte pour un complexe soluble en grand excès d’antigène est du type Ag2-Ac qui démontre la divalence de l’anticorps. La courbe (3) extrapolée à son point d’intersection avec l’axe des ordonnées du rapport molaire Ag-Ac (c’est-à-dire en grand excès d’anticorps) permet de calculer la valence minimum de l’antigène.La précipitation Ag-Ac s’interprète correctement par la théorie de Marrack (1933) ultérieurement affinée par divers auteurs sur le plan mathématique. Cette théorie postule la formation d’un réseau tridimensionnel intermoléculaire entre les divers épitopes de l’antigène et les molécules d’anticorps spécifiques.Précipitation en milieu gélifiéLes techniques d’analyse immunochimique qualitative ou quantitative en milieu gélifié (tabl. 3) peuvent être divisées en deux groupes: immunodiffusion des antigènes et des anticorps en l’absence de champ électrique et immunodiffusion associant l’action d’un tel champ. Dans les deux types de méthodes la diffusion peut être unidimensionnelle ou bidimensionnelle.Immunodiffusion en l’absence d’un champ électriqueDeux modalités techniques ont été proposées par Oudin en 1946: l’antigène en solution diffuse dans un gel contenant l’anticorps: c’est la diffusion simple; les deux réactifs (antigène et anticorps) diffusent l’un vers l’autre dans une couche de gel vierge: c’est la diffusion double (technique la plus utilisée).Ces deux types d’analyse peuvent être effectués en tubes, en cuves à faces parallèles (technique d’Oudin) ou en plaque (techniquepréconisée en 1948 par Elek et Ouchterlony). Dans la diffusion double, en tubes ou en cuves, le système est formé de trois couches: une première couche contenant l’immunsérum ou la solution d’anticorps incorporés dans de la gélose (couche inférieure); une deuxième couche contenant la gélose seule; une troisième couche contenant la solution d’antigène qui est ou qui n’est pas gélosée (fig. 4 a).Dans la diffusion double en plaques, le gel vierge est coulé sur une surface de verre (plaque de verre ou boîte de Pétri). Les réactifs diffusent soit à partir de bandes de papier disposées à la surface du gel (technique d’Elek relativement peu utilisée), soit à partir de réservoirs ménagés dans le gel (technique d’Ouchterlony d’un emploi universel). Les sources de diffusion peuvent être disposées de différentes manières: puits circulaires (le plus fréquemment), triangulaires ou rectangulaires creusés avec un emporte-pièce dans la gélose (fig. 3 et 4 b, c).Quel que soit le type de diffusion étudié, les règles suivantes ont été énoncées par Oudin:– La réactivité d’un seul antigène donne naissance à une seule zone de précipitation;– Si plusieurs antigènes sans réactivité croisée réagissent simultanément dans un même gel avec leurs anticorps respectifs, ils se comportent d’une manière indépendante. Les différentes zones de précipitation (au maximum autant de zones que d’antigènes différents) apparaissent et évoluent indépendamment les unes des autres;– Le mouvement ou l’immobilité d’une zone de précipitation dépend essentiellement du rapport des concentrations initiales Agi d’antigène et Aci d’anticorps. Si ce rapport correspond à l’équivalence dans la réaction en milieu liquide, la zone de précipitation sera immobile. Dans le cas contraire, la zone se déplace au cours du temps en s’éloignant de la source de réactif qui est en excès;– La distance de la frontière de la zone de précipitation à l’interface entre les deux couches est très sensiblement proportionnelle à la racine carrée du temps écoulé:
En raison de cette double multivalence, il est impossible de définir une constante d’association globale des anticorps permettant d’évaluer quantitativement l’ensemble des forces mises en jeu pour former le complexe. Pendant longtemps le concept d’avidité avait prévalu comme reflet de cette affinité globale. On pouvait évaluer grossièrement l’avidité d’un immunsérum en étudiant l’effet de la dilution sur un mélange d’antigène et d’immunsérum, ce qui a pour effet de réduire la concentration d’antigène et d’anticorps libre et donc de dissocier le complexe.Une série d’observations expérimentales étayées par diverses approches théoriques a permis d’aboutir au concept d’affinité fonctionnelle, qui traduit le fait que l’affinité d’une molécule d’anticorps bivalente (IgG, IgE) ou multivalente (IgA, IgM) n’était pas égale à la somme arithmétique de l’affinité de chaque site considéré séparément, mais beaucoup plus élevée, souvent par plusieurs ordres de grandeur (102 à 106). En d’autres termes, une stabilité supplémentaire est conférée à un complexe Ag-Ac lorsque la molécule d’anticorps réagit avec plus d’un déterminant. Ce renforcement a été observé aussi bien pour une molécule d’anticorps reliant deux épitopes sur deux molécules d’antigène ou des épitopes répétitifs (liaison monogame) présents sur une même molécule (antigènes polyosidiques) ou sur une même structure (motifs hapténiques répétitifs, épitopes à la surface de cellules ou de capsides virales). L’affinité fonctionnelle, terme qui doit être utilisé de préférence à celui d’avidité, dépend évidemment de l’affinité intrinsèque des sites anticorps, mais implique aussi la contribution d’autres facteurs, tels les valences de l’antigène et de l’anticorps. Différents autres paramètres, non liés directement à l’interaction primaire entre sites, anticorps et épitopes, sont également impliqués dans ce phénomène d’amplification, tels l’amplitude de l’écartement de la région charnière des molécules d’immunoglobulines et, vraisemblablement, différentes conformations topologiques. La réalité de cette amplification de l’affinité a pu être apportée par la mesure comparée de l’affinité de fragments monovalents (Fab) d’IgG ou d’IgM par rapport à celle des molécules intactes.Les implications biologiques de l’affinité fonctionnelle sont très importantes sur le plan de l’immunité anti-bactérienne ou anti-virale et pour les réactions de stimulation à point de départ membranaire (cellules lymphoïdes, cellules tumorales...). Elle peut expliquer la remarquable activité biologique in vivo à très faible concentration des anticorps dirigés contre les micro-organismes, souvent porteurs de motifs répétitifs.Les interactions primaires (étudiées ci-dessus) ne prennent en compte que les réactions entre les molécules d’antigènes et les anticorps homologues indépendamment des effets physicochimiques et biologiques (y compris leurs manifestations macroscopiques) qui en découlent. Ces réactions dépendent uniquement de la quantité et de l’affinité des anticorps.Les manifestations secondaires des interactions primaires sont nombreuses (tabl. 1). Les phénomènes d’immunoprécipitation, d’agglutination et les réactions impliquant le complément, pour ne citer que les plus courants bien que traduisant les réactions élémentaires sites anticorps-épitopes, ont des caractéristiques propres indépendantes de cette interaction. Ainsi, certains anticorps donnent bien lieu à des précipités; mais d’autres ne présentent pas cette propriété. Les réactions d’agglutination sont 50 à 100 fois moins sensibles pour les IgG que pour les IgM. Les IgA et les IgE qui ne fixent pas le composant C1q du système complément n’interviennent pas dans les phénomènes de cytolyse impliquant la participation de ce système. L’utilité des réactions secondaires est toutefois considérable pour l’analyse qualitative et quantitative des antigènes et des anticorps et de la réaction Ag-Ac, notamment pour ce qui est des réactions de précipitation, des réactions immunoenzymatiques et des réactions d’agglutination.4. Réactions de précipitation (immunoprécipitation)Véritable modèle du genre par sa simplicité et son immense champ d’application, la précipitation spécifique entre un antigène et les anticorps homologues est indiscutablement la plus importante réaction Ag-Ac in vitro . Cette réaction, dans ses deux aspects qualitatif et quantitatif, aussi bien en milieu liquide qu’en milieu gélifié, a eu une importance historique considérable par les progrès théoriques et pratiques qu’elle a permis de réaliser en immunologie, non seulement sur le plan analytique, mais aussi pour le développement de nombreux concepts fondamentaux de cette discipline.Découverte en 1897 par Kraus, cette réaction se traduit par la formation plus ou moins rapide (quelques minutes à plusieurs heures) d’un agrégat (appelé parfois floculat) visible à l’œil nu lorsqu’on mélange, dans des proportions appropriées et à des concentrations suffisantes, un immunsérum ou une solution d’anticorps avec une solution de l’antigène homologue. L’agrégat, d’abord dispersé dans l’ensemble de la phase liquide, se dépose progressivement sous la forme d’un précipité dans le mélange réactionnel dont il peut être séparé par centrifugation.Si, au lieu de mélanger la solution d’antigène et l’immunsérum, on les superpose (sans mélange) dans un tube fin, l’immunsérum plus dense étant au fond, le précipité formé se présente sous la forme d’un disque fin visible qui apparaît en quelques minutes (pour un sérum de bonne affinité) à l’interface des deux liquides. Cette épreuve qualitative de précipitation interfaciale, ou «ring-test», est couramment utilisée comme méthode exploratoire rapide et fiable pour la détection des anticorps précipitants dans un immunsérum. Mais c’est surtout après l’établissement des méthodes quantitatives d’étude de la réaction de précipitation Ag-Ac par M. Heidelberger et son école (Wu, Randall), à partir de 1928, puis par E. Kabat, que cette réaction connut son véritable essor comme fondement de l’immunochimie quantitative .L’importance de cette méthodologie a été capitale à plusieurs égards:– elle a permis de démontrer de manière définitive que les anticorps étaient des protéines;– elle a introduit une dimension quantitative en immunologie (dosage des antigènes et des anticorps) qui, jusqu’alors, était restée essentiellement descriptive;– elle a conduit à proposer puis à démontrer la multivalence des antigènes, la divalence ou la multivalence des anticorps et de ce fait, à permis à Marrack dès 1933 de proposer la théorie du réseau décrit plus loin;– elle a permis de démontrer l’immunogénicité de macromolécules autres que les protéines, notamment les polyosides dont la structure répétitive a permis d’en utiliser des fragments comme haptènes pour déterminer la taille des épitopes et du site anticorps.En 1946, à l’Institut Pasteur de Paris, Jacques Oudin eut l’idée de remplacer le milieu liquide, dans lequel la réaction de précipitation était jusque-là effectuée, par un milieu gélifié qui freinerait la sédimentation. Ce type d’analyse, complété à partir de 1953 par l’introduction d’un champ électrique, proposé par P. Grabar et C. Williams, devait s’avérer l’outil le plus puissant pour l’analyse de mélanges même très complexes d’antigènes ou d’anticorps (ce qui ne peut être réalisé par la précipitation en milieu liquide). Il devait être également à la base de la découverte par J. Oudin des phénomènes fondamentaux que sont l’allotypie et l’idiotypie.Précipitation quantitative en milieu liquideLa réaction de précipitation Ag-Ac est un processus complexe qui peut se décomposer en deux stades: d’abord combinaison des divers épitopes et des sites anticorps homologues (interaction primaire) de cinétique rapide de l’ordre de la fraction de seconde; ensuite, réactions secondaires en chaînes, variables selon les proportions d’antigènes et d’anticorps qui aboutissent à la formation des agrégats et à leur insolubilisation éventuelle. Ce deuxième stade se déroule beaucoup plus lentement que le premier et sa vitesse dépend des rapports de concentration des espèces moléculaires présentes et de caractéristiques propres à chaque système.Ces données permettent d’envisager l’évaluation quantitative de deux types de paramètres: le temps d’apparition des précipités et la quantité d’anticorps précipité. Selon le paramètre choisi, deux méthodologies différentes s’appliquent. Celle basée sur le temps de précipitation (techniques dites de floculation de Ramon et de Dean et Webb) n’est utilisée que de manière limitée et s’applique au dosage des toxines bactériennes ou de venins et de leurs anticorps. En revanche, la mesure de la quantité d’anticorps précipité, c’est-à-dire l’établissement de la courbe de précipitation quantitative antigène – anticorps, est de portée beaucoup plus générale et très largement utilisée. Outre son intérêt théorique mentionné plus haut, elle permet le dosage précis des antigènes et de leurs anticorps précipitants. Elle sert aussi de base pour les autres techniques de mesure de la réaction Ag-Ac pour estimer les rapports éventuels entre les titres en anticorps trouvés par ces techniques et la teneur en anticorps précipitants.La figure 2 rassemble l’ensemble des résultats expérimentaux et leur interprétation. Pour la plupart des immunsérums humains ou de différentes espèces animales (sauf pour certains sérums équins), le graphe qui représente la quantité de complexe Ag-Ac précipité en fonction de la quantité d’antigène possède une allure parabolique (courbe 1). La quantité de complexe augmente pour atteindre un point maximum puis diminue. L’analyse des surnageants et des précipités montre que l’on peut distinguer trois zones: une zone centrale II, dite zone d’équivalence pour laquelle l’antigène et l’anticorps introduits sont totalement dans le précipité, entourée à gauche par une zone d’excès d’anticorps (I) mais où tout l’antigène est (en principe) dans le précipité et, à droite, par une zone d’excès d’antigène (III), où une partie de celui-ci est sous forme de complexe soluble et l’autre partie est dans le précipité. Plus la quantité d’antigène sera élevée plus la fraction de complexe soluble sera importante.Une fois connus les poids des complexes immuns précipités, on peut évaluer la quantité d’anticorps précipité. Si l’antigène n’est pas protéique, la totalité des protéines du précipité représentera l’anticorps. La situation est plus complexe lorsque l’antigène est protéique car il faudra déduire de la quantité totale d’azote ou de protéine du précipité, celle correspondant à l’antigène (courbe 2). Cette opération n’a de sens que dans la zone d’excès d’anticorps et d’équivalence où, a priori, tout l’antigène introduit est dans le précipité. Si l’on désire connaître la quantité d’anticorps précipité en zone d’excès d’antigène (courbe 2 en pointillé), celui-ci devrait pouvoir être repérable par marquage avec un radio-isotope ou par une fluorochrome. Connaissant la quantité d’anticorps dans les précipités, il est alors possible de calculer, pour chaque mélange Ag-Ac étudié, le rapport de molécules d’Ac et d’Ag dans les complexes insolubles. Ce rapport décroît pour beaucoup de systèmes linérairement avec la quantité x d’antigène introduit (courbe 3).La stoechiométrie complexe de la réaction de précipitation s’explique par l’implication simultanée de trois facteurs: divalence ou multivalence des anticorps; multivalence (structure multiépitopique) des antigènes; réversibilité partielle (lente mais réelle) des complexes.Ces caractéristiques rendent compte de la variabilité de la composition relative en antigène et en anticorps des précipités et des complexes solubles en zone d’excès d’antigène tout le long de la courbe. En excès d’anticorps, chaque molécule multiépitopique d’antigène s’unira avec beaucoup plus de molécules d’anticorps que dans les zones d’équivalence ou d’excès d’antigène. Inversement, en excès d’antigène, le précipité sera plus riche en molécules d’antigène que d’anticorps. On remarquera (fig. 2) que l’extrême limite atteinte pour un complexe soluble en grand excès d’antigène est du type Ag2-Ac qui démontre la divalence de l’anticorps. La courbe (3) extrapolée à son point d’intersection avec l’axe des ordonnées du rapport molaire Ag-Ac (c’est-à-dire en grand excès d’anticorps) permet de calculer la valence minimum de l’antigène.La précipitation Ag-Ac s’interprète correctement par la théorie de Marrack (1933) ultérieurement affinée par divers auteurs sur le plan mathématique. Cette théorie postule la formation d’un réseau tridimensionnel intermoléculaire entre les divers épitopes de l’antigène et les molécules d’anticorps spécifiques.Précipitation en milieu gélifiéLes techniques d’analyse immunochimique qualitative ou quantitative en milieu gélifié (tabl. 3) peuvent être divisées en deux groupes: immunodiffusion des antigènes et des anticorps en l’absence de champ électrique et immunodiffusion associant l’action d’un tel champ. Dans les deux types de méthodes la diffusion peut être unidimensionnelle ou bidimensionnelle.Immunodiffusion en l’absence d’un champ électriqueDeux modalités techniques ont été proposées par Oudin en 1946: l’antigène en solution diffuse dans un gel contenant l’anticorps: c’est la diffusion simple; les deux réactifs (antigène et anticorps) diffusent l’un vers l’autre dans une couche de gel vierge: c’est la diffusion double (technique la plus utilisée).Ces deux types d’analyse peuvent être effectués en tubes, en cuves à faces parallèles (technique d’Oudin) ou en plaque (techniquepréconisée en 1948 par Elek et Ouchterlony). Dans la diffusion double, en tubes ou en cuves, le système est formé de trois couches: une première couche contenant l’immunsérum ou la solution d’anticorps incorporés dans de la gélose (couche inférieure); une deuxième couche contenant la gélose seule; une troisième couche contenant la solution d’antigène qui est ou qui n’est pas gélosée (fig. 4 a).Dans la diffusion double en plaques, le gel vierge est coulé sur une surface de verre (plaque de verre ou boîte de Pétri). Les réactifs diffusent soit à partir de bandes de papier disposées à la surface du gel (technique d’Elek relativement peu utilisée), soit à partir de réservoirs ménagés dans le gel (technique d’Ouchterlony d’un emploi universel). Les sources de diffusion peuvent être disposées de différentes manières: puits circulaires (le plus fréquemment), triangulaires ou rectangulaires creusés avec un emporte-pièce dans la gélose (fig. 3 et 4 b, c).Quel que soit le type de diffusion étudié, les règles suivantes ont été énoncées par Oudin:– La réactivité d’un seul antigène donne naissance à une seule zone de précipitation;– Si plusieurs antigènes sans réactivité croisée réagissent simultanément dans un même gel avec leurs anticorps respectifs, ils se comportent d’une manière indépendante. Les différentes zones de précipitation (au maximum autant de zones que d’antigènes différents) apparaissent et évoluent indépendamment les unes des autres;– Le mouvement ou l’immobilité d’une zone de précipitation dépend essentiellement du rapport des concentrations initiales Agi d’antigène et Aci d’anticorps. Si ce rapport correspond à l’équivalence dans la réaction en milieu liquide, la zone de précipitation sera immobile. Dans le cas contraire, la zone se déplace au cours du temps en s’éloignant de la source de réactif qui est en excès;– La distance de la frontière de la zone de précipitation à l’interface entre les deux couches est très sensiblement proportionnelle à la racine carrée du temps écoulé: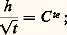 – Pour un temps donné, la pénétration (h ) de la zone de précipitation est proportionnelle au logarithme de la concentration de l’antigène (Ag). La pénétration h ne s’écarte quasi pas d’une ligne droite et se conforme sensiblement à l’équation:
– Pour un temps donné, la pénétration (h ) de la zone de précipitation est proportionnelle au logarithme de la concentration de l’antigène (Ag). La pénétration h ne s’écarte quasi pas d’une ligne droite et se conforme sensiblement à l’équation: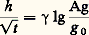 où Ag est la concentration initiale de l’antigène diffusant, 塚 et g 0, des constantes;– La concentration des anticorps exerce sur la pénétration de la zone de précipitation h une influence analogue à celle de la concentration de l’antigène, mais en sens inverse de celle-ci. La pénétration h de la zone de précipitation, pour un temps donné, est une fonction linéaire du logarithme de la concentration des anticorps:
où Ag est la concentration initiale de l’antigène diffusant, 塚 et g 0, des constantes;– La concentration des anticorps exerce sur la pénétration de la zone de précipitation h une influence analogue à celle de la concentration de l’antigène, mais en sens inverse de celle-ci. La pénétration h de la zone de précipitation, pour un temps donné, est une fonction linéaire du logarithme de la concentration des anticorps: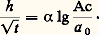 Ces techniques analytiques permettent le dénombrement des antigènes contenus dans un mélange, et leur identification (fig. 3 et 4 b, c). Elles permettent également le dosage des antigènes et éventuellement des anticorps.Dénombrement des antigènesLe nombre observé des zones de précipitation peut être raisonnablement considéré comme le nombre minimal des antigènes qui réagissent, le nombre des antigènes présents pouvant toujours être plus grand que le nombre des zones de précipitation si l’on tient compte de la possibilité pour certains antigènes de ne pas donner de zone visible ou distincte.Identification des antigènesL’identification consiste à reconnaître la présence ou l’absence d’un même antigène dans plusieurs solutions, dans le cas le plus fréquent à reconnaître la zone d’un même antigène dans la réaction de deux ou plusieurs solutions avec le même immunsérum ou avec plusieurs immunsérums différents. Un des moyens les plus utilisés consiste à étudier les réactions de voisinage en plaque (fig. 3 et 4 b, c).Lorsqu’un même antigène est présent dans des puits voisins, les zones de précipitation n’en seront qu’une seule (coalescence). Il s’agira donc d’identité antigénique totale. Si les antigènes n’ont aucun déterminant commun et sont donc totalement différents, les zones de précipitation se coupent mutuellement. Enfin, en cas de présence de déterminants communs entre deux antigènes ayant par ailleurs des déterminants spécifiques de chacun d’eux, on observera une coalescence partielle qui se traduit par la formation d’un éperon entre les zones réagissantes et par un affaiblissement de l’intensité du précipité au-delà du point de jonction des deux zones.Dosage des antigènes et des anticorpsCe dosage peut s’effectuer par les techniques de diffusion simple en tube, en se basant sur les lois linéaires auxquelles obéit la distance h , en un temps donné par la zone de précipitation, en fonction du logarithme de la concentration initiale d’antigène et celui de la concentration initiale d’anticorps.Diffusion simpleActuellement une technique simple dite d’immunodiffusion radiale, décrite par Mancini, permet le dosage de l’antigène en milieu gélose en plaque, en se basant sur les lois précédentes. Il a été montré que, lorsqu’un antigène soluble est mis à diffuser radialement à partir d’un réservoir creusé dans un gel contenant l’immunsérum ou les anticorps homologues, il se produit un précipité annulaire dont le diamètre D est proportionnel à la racine carrée de la concentration (C) de l’antigène (loi parabolique de Sandor). Cette relation s’écrit
Ces techniques analytiques permettent le dénombrement des antigènes contenus dans un mélange, et leur identification (fig. 3 et 4 b, c). Elles permettent également le dosage des antigènes et éventuellement des anticorps.Dénombrement des antigènesLe nombre observé des zones de précipitation peut être raisonnablement considéré comme le nombre minimal des antigènes qui réagissent, le nombre des antigènes présents pouvant toujours être plus grand que le nombre des zones de précipitation si l’on tient compte de la possibilité pour certains antigènes de ne pas donner de zone visible ou distincte.Identification des antigènesL’identification consiste à reconnaître la présence ou l’absence d’un même antigène dans plusieurs solutions, dans le cas le plus fréquent à reconnaître la zone d’un même antigène dans la réaction de deux ou plusieurs solutions avec le même immunsérum ou avec plusieurs immunsérums différents. Un des moyens les plus utilisés consiste à étudier les réactions de voisinage en plaque (fig. 3 et 4 b, c).Lorsqu’un même antigène est présent dans des puits voisins, les zones de précipitation n’en seront qu’une seule (coalescence). Il s’agira donc d’identité antigénique totale. Si les antigènes n’ont aucun déterminant commun et sont donc totalement différents, les zones de précipitation se coupent mutuellement. Enfin, en cas de présence de déterminants communs entre deux antigènes ayant par ailleurs des déterminants spécifiques de chacun d’eux, on observera une coalescence partielle qui se traduit par la formation d’un éperon entre les zones réagissantes et par un affaiblissement de l’intensité du précipité au-delà du point de jonction des deux zones.Dosage des antigènes et des anticorpsCe dosage peut s’effectuer par les techniques de diffusion simple en tube, en se basant sur les lois linéaires auxquelles obéit la distance h , en un temps donné par la zone de précipitation, en fonction du logarithme de la concentration initiale d’antigène et celui de la concentration initiale d’anticorps.Diffusion simpleActuellement une technique simple dite d’immunodiffusion radiale, décrite par Mancini, permet le dosage de l’antigène en milieu gélose en plaque, en se basant sur les lois précédentes. Il a été montré que, lorsqu’un antigène soluble est mis à diffuser radialement à partir d’un réservoir creusé dans un gel contenant l’immunsérum ou les anticorps homologues, il se produit un précipité annulaire dont le diamètre D est proportionnel à la racine carrée de la concentration (C) de l’antigène (loi parabolique de Sandor). Cette relation s’écrit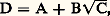 où A et B sont deux constantes dépendant respectivement de l’ordonnée à l’origine et de la pente de la droite de référence. En portant, sur un système d’axes, le diamètre des anneaux de précipitation et la racine carrée des concentrations d’antigènes, on obtient une droite. Une autre méthode d’évaluation est la méthode préconisée par Mancini qui relie la surface S du précipité annulaire à la quantité Q d’antigène selon l’équation:
où A et B sont deux constantes dépendant respectivement de l’ordonnée à l’origine et de la pente de la droite de référence. En portant, sur un système d’axes, le diamètre des anneaux de précipitation et la racine carrée des concentrations d’antigènes, on obtient une droite. Une autre méthode d’évaluation est la méthode préconisée par Mancini qui relie la surface S du précipité annulaire à la quantité Q d’antigène selon l’équation: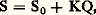 où K est la pente de la droite d’étalonnage.Immunodiffusion associant l’action d’un champ électriqueCette méthodologie concerne les différents aspects de l’analyse immunoélectrophorétique (souvent désignée immunoélectrophorèse), mise au point par Grabar et Williams, et concernant actuellement de nombreuses techniques qui en dérivent (tabl. 3).Dans un gel aqueux transparent, on fait migrer par électrophorèse les constituants du liquide à examiner. On fait ensuite diffuser perpendiculairement à l’axe de migration un immunsérum contenant des anticorps précipitant les constituants (antigènes) du mélange. Lorsque ces anticorps rencontrent les antigènes homologues en proportions convenables, des arcs de précipitations spécifiques se forment dans le gel. Ce dernier étant transparent, les arcs sont visibles et peuvent être photographiés (fig. 4 d). Il est cependant préférable de colorer ces arcs par des colorants appropriés. Les précipités contenant surtout des anticorps, donc des protéines, sont facilement colorables par les colorants classiques des protéines. Des colorants spéciaux permettent de préciser la nature chimique des antigènes s’ils contiennent des lipides, des glucides, des acides nucléiques, des métaux, etc. ou si les antigènes possèdent une activité enzymatique.L’analyse immunoélectrophorétique est devenue bidimensionnelle en 1960 (Ressler, Laurell), puis quantitative en 1966 (Clarke et Freeman), puis elle s’est affranchie de la nécessaire précipitation à l’équilibre par les diverses techniques d’immunodétection ou d’immuno-affinité (Awdeh, 1968; Keck, 1973). Par ces techniques, les antigènes séparés par électrophorèse sont fixés chimiquement et détectés par des anticorps spécifiques marqués par des enzymes ou par des radio-isotopes. En 1975, Southern mettait au point la technique des immunoempreintes sur feuille de nitrate de cellulose qui immobilise les constituants séparés, permettant ainsi d’éviter la fixation chimique peu efficace et en partie dénaturante. La détection immunochimique sur l’empreinte s’effectue par des anticorps marqués par un isotope, une enzyme ou une molécule fluorescente. On désigne souvent par le terme de western blot ce type de méthodologie.En fonction de ces données, les techniques actuelles immunoélectrophorétiques impliquent la combinaison selon diverses modalités des deux étapes de l’analyse:a ) Séparation électrophorétique: électrophorèse de zone, isoélectrofocalisation dans un gradient de pH, isotachophorèse, combinaison bidimensionnelle de deux techniques de principes différents, supports variés (agarose, gels de polyacrylamide, gels mixtes, acétate de cellulose).b ) Reconnaissance ou détection immunochimique:– soit par précipitation Ag-Ac: double diffusion, migration électrophorétique des antigènes et des anticorps appelée contre-immunoélectrophorèse ou électrosynérèse décrite par Bussard, immunoélectrophorèse en fusée («rocket») de Laurell, migration électrophorétique des antigènes préalablement séparés par électrophorèse orthogonalement dans un gel contenant les anticorps, selon Rissler et Laurell illustrée par la figure 4 d, appelée électrophorèse croisée;– soit par immunomarquage après immobilisation des antigènes par précipitation Ag-Ac, après immobilisation chimique ou physique des antigènes séparés par isoélectrofocalisation, après immobilisation sur une empreinte ou réplique des antigènes (Southern, Towbin, Peltre) après séparation similaire.La sensibilité comparée des différentes techniques immunologiques dans la réaction Ag-Ac figure sur le tableau 4.5. Immunoanalyse par les méthodes immunoenzymologiquesCette méthodologie d’immunodosages quantitatifs fondée sur l’interaction primaire Ag-Ac est, à l’heure actuelle, une des plus utilisées en immunoanalyse. Elle a été proposée pour la première fois en 1971 par trois équipes de recherche: en France par Avraméas et Guibert, aux Pays-Bas par Van Weeman et Schnurs et en Suède par Engvall et Perlmann qui l’ont décrite sous l’acronyme Elisa (pour Enzyme Linked Sorbent Assay ) universellement utilisé depuis 1971.Cette réaction immunologique est fondée sur une technique de marquage par une enzyme de l’un des éléments, l’antigène ou l’anticorps, qui intervient dans la réaction. L’utilisation d’enzymes comme marqueur présentait l’avantage considérable de conférer une grande sensibilité à la réaction Ag-Ac en raison de la propriété de l’enzyme liée à l’un des partenaires de la réaction (le plus souvent l’anticorps) de transformer un très grand nombre de molécules de substrat, c’est-à-dire à l’amplification du signal servant de révélateur de la réaction.Les modalités de la réaction sont très variées. Elles permettent de doser soit l’antigène, soit l’anticorps. Elles peuvent s’effectuer en phase hétérogène ou homogène selon un processus de type compétitif ou non compétitif. Elles sont actuellement pratiquées le plus souvent dans les cupules de microplaques en matière plastique. On les exécute manuellement ou à l’aide de machines automatiques dotées d’un enregistrement sur bandes imprimantes. Pour être fiables, les réactions immunoenzymatiques nécessitent l’emploi de préparations d’antigènes et d’anticorps polyclonaux ou monoclonaux très spécifiques et soigneusement purifiés et contrôlés.6. Réactions d’agglutinationL’agglutination immunologique a été découverte par Gruber et Durham à la fin du XIXe siècle, avec des suspensions bactériennes incubées avec les immunsérums homologues. Ce phénomène est général et s’applique à tout système où les antigènes sont associés à une particule biologique (cellule) ou inerte (latex, bentonite) ayant été préalablement «sensibilisée» par adsorption ou fixation chimique de molécules antigéniques à leur surface. contrairement à la réaction de précipitation, où l’on observe l’apparition d’un produit insoluble après mélange de solutions limpides d’antigène et d’anticorps, dans la réaction d’agglutination on observe la clarification de la suspension antigénique particulaire par suite de la formation d’agrégats qui se déposent au fond du tube. L’agglutination s’observe également sur des surfaces (lames de verre ou de plastique) sur lesquelles sont déposés la suspension antigénique et l’immunsérum ou une solution d’anticorps.On distingue les agglutinations naturelles observées avec les bactéries ou les cellules, notamment les hématies (hémagglutination), et les agglutinations ou hémagglutinations passives, ou conditionnées, lorsque des cellules ou des particules sont sensibilisées par fixation d’antigènes solubles. Le couplage des antigènes peut être obtenu par divers procédés: traitement par le chlorure de chrome, la benzidine bis-diazotée et surtout, actuellement, le glutaraldéhyde et les carbodiimides.L’inhibition de l’hémagglutination passive par l’antigène soluble (incubé préalablement avec l’anticorps) est la technique de choix pour une détermination quantitative de l’antigène. Elle est surtout utilisée pour le dosage d’hormones plasmatiques ou urinaires, notamment dans le diagnostic immunologique de la grossesse.L’agglutination directe est utilisée pour le sérodiagnostic d’affections microbiennes (par exemple, réaction de Widal pour le diagnostic de la typhoïde) pour la détermination des groupes sanguins, etc. Signalons que de nombreux anticorps réagissent mieux à 37 0C qu’à 4 0C mais que, cependant, certains n’agglutinent qu’à 4 0C («agglutinines froides»). Certains anticorps sont «non agglutinants» bien que bivalents ou multivalents. La notion d’anticorps agglutinant et non agglutinant est toutefois relative et dépend de la structure moléculaire de l’anticorps et donc de sa valence (en règle générale les IgM sont plus agglutinants que les IgG), de la densité épitopique à la surface des cellules ou particules et de la force ionique du milieu. L’agglutination dépend de deux paramètres complémentaires: la création de ponts entre les cellules (fig. 5) et l’abaissement des forces de répulsion électrique entre les cellules.
où K est la pente de la droite d’étalonnage.Immunodiffusion associant l’action d’un champ électriqueCette méthodologie concerne les différents aspects de l’analyse immunoélectrophorétique (souvent désignée immunoélectrophorèse), mise au point par Grabar et Williams, et concernant actuellement de nombreuses techniques qui en dérivent (tabl. 3).Dans un gel aqueux transparent, on fait migrer par électrophorèse les constituants du liquide à examiner. On fait ensuite diffuser perpendiculairement à l’axe de migration un immunsérum contenant des anticorps précipitant les constituants (antigènes) du mélange. Lorsque ces anticorps rencontrent les antigènes homologues en proportions convenables, des arcs de précipitations spécifiques se forment dans le gel. Ce dernier étant transparent, les arcs sont visibles et peuvent être photographiés (fig. 4 d). Il est cependant préférable de colorer ces arcs par des colorants appropriés. Les précipités contenant surtout des anticorps, donc des protéines, sont facilement colorables par les colorants classiques des protéines. Des colorants spéciaux permettent de préciser la nature chimique des antigènes s’ils contiennent des lipides, des glucides, des acides nucléiques, des métaux, etc. ou si les antigènes possèdent une activité enzymatique.L’analyse immunoélectrophorétique est devenue bidimensionnelle en 1960 (Ressler, Laurell), puis quantitative en 1966 (Clarke et Freeman), puis elle s’est affranchie de la nécessaire précipitation à l’équilibre par les diverses techniques d’immunodétection ou d’immuno-affinité (Awdeh, 1968; Keck, 1973). Par ces techniques, les antigènes séparés par électrophorèse sont fixés chimiquement et détectés par des anticorps spécifiques marqués par des enzymes ou par des radio-isotopes. En 1975, Southern mettait au point la technique des immunoempreintes sur feuille de nitrate de cellulose qui immobilise les constituants séparés, permettant ainsi d’éviter la fixation chimique peu efficace et en partie dénaturante. La détection immunochimique sur l’empreinte s’effectue par des anticorps marqués par un isotope, une enzyme ou une molécule fluorescente. On désigne souvent par le terme de western blot ce type de méthodologie.En fonction de ces données, les techniques actuelles immunoélectrophorétiques impliquent la combinaison selon diverses modalités des deux étapes de l’analyse:a ) Séparation électrophorétique: électrophorèse de zone, isoélectrofocalisation dans un gradient de pH, isotachophorèse, combinaison bidimensionnelle de deux techniques de principes différents, supports variés (agarose, gels de polyacrylamide, gels mixtes, acétate de cellulose).b ) Reconnaissance ou détection immunochimique:– soit par précipitation Ag-Ac: double diffusion, migration électrophorétique des antigènes et des anticorps appelée contre-immunoélectrophorèse ou électrosynérèse décrite par Bussard, immunoélectrophorèse en fusée («rocket») de Laurell, migration électrophorétique des antigènes préalablement séparés par électrophorèse orthogonalement dans un gel contenant les anticorps, selon Rissler et Laurell illustrée par la figure 4 d, appelée électrophorèse croisée;– soit par immunomarquage après immobilisation des antigènes par précipitation Ag-Ac, après immobilisation chimique ou physique des antigènes séparés par isoélectrofocalisation, après immobilisation sur une empreinte ou réplique des antigènes (Southern, Towbin, Peltre) après séparation similaire.La sensibilité comparée des différentes techniques immunologiques dans la réaction Ag-Ac figure sur le tableau 4.5. Immunoanalyse par les méthodes immunoenzymologiquesCette méthodologie d’immunodosages quantitatifs fondée sur l’interaction primaire Ag-Ac est, à l’heure actuelle, une des plus utilisées en immunoanalyse. Elle a été proposée pour la première fois en 1971 par trois équipes de recherche: en France par Avraméas et Guibert, aux Pays-Bas par Van Weeman et Schnurs et en Suède par Engvall et Perlmann qui l’ont décrite sous l’acronyme Elisa (pour Enzyme Linked Sorbent Assay ) universellement utilisé depuis 1971.Cette réaction immunologique est fondée sur une technique de marquage par une enzyme de l’un des éléments, l’antigène ou l’anticorps, qui intervient dans la réaction. L’utilisation d’enzymes comme marqueur présentait l’avantage considérable de conférer une grande sensibilité à la réaction Ag-Ac en raison de la propriété de l’enzyme liée à l’un des partenaires de la réaction (le plus souvent l’anticorps) de transformer un très grand nombre de molécules de substrat, c’est-à-dire à l’amplification du signal servant de révélateur de la réaction.Les modalités de la réaction sont très variées. Elles permettent de doser soit l’antigène, soit l’anticorps. Elles peuvent s’effectuer en phase hétérogène ou homogène selon un processus de type compétitif ou non compétitif. Elles sont actuellement pratiquées le plus souvent dans les cupules de microplaques en matière plastique. On les exécute manuellement ou à l’aide de machines automatiques dotées d’un enregistrement sur bandes imprimantes. Pour être fiables, les réactions immunoenzymatiques nécessitent l’emploi de préparations d’antigènes et d’anticorps polyclonaux ou monoclonaux très spécifiques et soigneusement purifiés et contrôlés.6. Réactions d’agglutinationL’agglutination immunologique a été découverte par Gruber et Durham à la fin du XIXe siècle, avec des suspensions bactériennes incubées avec les immunsérums homologues. Ce phénomène est général et s’applique à tout système où les antigènes sont associés à une particule biologique (cellule) ou inerte (latex, bentonite) ayant été préalablement «sensibilisée» par adsorption ou fixation chimique de molécules antigéniques à leur surface. contrairement à la réaction de précipitation, où l’on observe l’apparition d’un produit insoluble après mélange de solutions limpides d’antigène et d’anticorps, dans la réaction d’agglutination on observe la clarification de la suspension antigénique particulaire par suite de la formation d’agrégats qui se déposent au fond du tube. L’agglutination s’observe également sur des surfaces (lames de verre ou de plastique) sur lesquelles sont déposés la suspension antigénique et l’immunsérum ou une solution d’anticorps.On distingue les agglutinations naturelles observées avec les bactéries ou les cellules, notamment les hématies (hémagglutination), et les agglutinations ou hémagglutinations passives, ou conditionnées, lorsque des cellules ou des particules sont sensibilisées par fixation d’antigènes solubles. Le couplage des antigènes peut être obtenu par divers procédés: traitement par le chlorure de chrome, la benzidine bis-diazotée et surtout, actuellement, le glutaraldéhyde et les carbodiimides.L’inhibition de l’hémagglutination passive par l’antigène soluble (incubé préalablement avec l’anticorps) est la technique de choix pour une détermination quantitative de l’antigène. Elle est surtout utilisée pour le dosage d’hormones plasmatiques ou urinaires, notamment dans le diagnostic immunologique de la grossesse.L’agglutination directe est utilisée pour le sérodiagnostic d’affections microbiennes (par exemple, réaction de Widal pour le diagnostic de la typhoïde) pour la détermination des groupes sanguins, etc. Signalons que de nombreux anticorps réagissent mieux à 37 0C qu’à 4 0C mais que, cependant, certains n’agglutinent qu’à 4 0C («agglutinines froides»). Certains anticorps sont «non agglutinants» bien que bivalents ou multivalents. La notion d’anticorps agglutinant et non agglutinant est toutefois relative et dépend de la structure moléculaire de l’anticorps et donc de sa valence (en règle générale les IgM sont plus agglutinants que les IgG), de la densité épitopique à la surface des cellules ou particules et de la force ionique du milieu. L’agglutination dépend de deux paramètres complémentaires: la création de ponts entre les cellules (fig. 5) et l’abaissement des forces de répulsion électrique entre les cellules.
Encyclopédie Universelle. 2012.
